12.12.2018
Forskningen kring signalräckan Notch öppnar möjligheter för att hitta sätt för ett av en hjärtinfarkt skadat hjärta att reparera sig självt genom att aktivera hjärtats latenta reparationsmekanismer.
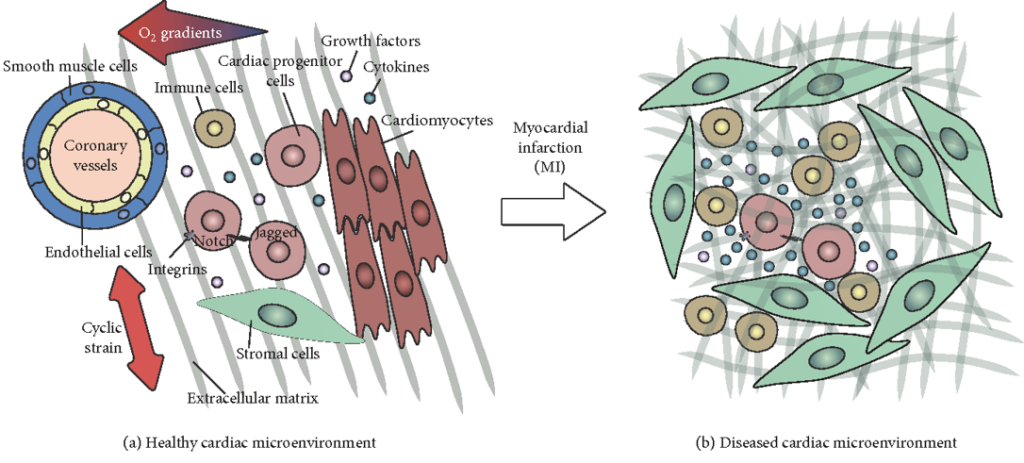
Hjärt- och kärlsjukdomar resulterar ofta i hjärtinfarkter som är en av de största dödsorsakerna i världen. Även om infarkten inte har dödlig utgång resulterar den i skador som kroppen har svårt att reparera. Det beror dels på att hjärtvävnad är ett komplext kompositmaterial som består av ett nätverk av sammandragande och stödande celler omgivna av en extracellulär matris som genomkorsas av nervbanor och blodkärl, och dels på att miljön i hjärtat är mekaniskt utmanande eftersom hjärtat rör på sig.
En infarkt åstadkommer en kraftig syrebrist som i sin tur leder till en mängd döda celler som kroppen sänder inflammationsceller till för att göra sig av med och hindra att celldöden sprider sig. Därefter akutreparerar kroppen skadan genom att bilda en ärrvävnad ovanpå den skadade vävnaden. Problemet med ärrvävnaden är att den inte har samma flexibilitet som den ursprungliga hjärtvävnaden och därför blir en belastning för hjärtats funktion.
Om ärrvävnaden hindrar hjärtats funktion kraftigt är hjärttransplantation en möjlighet. Men en hjärttransplantation är mycket resurskrävande (främst för att ett nytt fungerande hjärta behövs), svårt, och för patienten riskabelt och dramatiskt.
Ett alternativ till transplantation är stamcellsterapi. För cirka tio år sedan fann man de stamceller som är specifika för hjärtvävnad. Man har försökt injicera stamceller rakt in i hjärtat för att stimulera återhämtningen av hjärtvävnaden – det har visat sig ha en begränsad positiv effekt.
– Jo, man har kunnat mäta en liten positiv inverkan, men effekten har inte varit bra på lång sikt, stamcellerna har inte integrerats i hjärtvävnaden utan kroppen har börjat stöta bort dem. Man kan inte säga att metoden varit någon succé, säger Cecilia Sahlgren, professor i cellbiologi vid Åbo Akademi.

Problemet som stamcellbehandlingen vill komma åt är alltså ärrvävnaden som blir kvar och att hjärtat i övrigt inte reparerar sig självt i tillräcklig utsträckning.
Ett alternativ till stamcellsinjektionerna är att försöka aktivera de inbyggda reparationsmekanismer som var aktiva när hjärtat skapades. Ett antal studier har bekräftat att dessa mekanismer finns latenta även hos vuxna personer – ett system av celler som kallas cardiac progenitor cells (CPC). Dessa celler är föremålet för Sahlgrens forskningsgrupps uppmärksamhet. Forskningen binder samman med forskningen kring signalräckan Notch som genom ligander (sändare) och receptorer (mottagare) på cellens membran utgör ett kommunikationssystem mellan celler.
– Vad vi försöker förstå är hur vi kan påverka reparationsmekanismerna, hur signalerna går, och hur dessa påverkas av hjärtats mekanik och miljö. Det är sambandet vi vill komma åt – och det gör vi genom att skapa en syntetisk miljö där vi kan påverka både mekanismen och miljön.
Vad vi försöker förstå är hur vi kan påverka reparationsmekanismerna, hur signalerna går, och hur dessa påverkas av hjärtats mekanik och miljö. Det är sambandet vi vill komma åt – och det gör vi genom att skapa en syntetisk miljö där vi kan påverka både mekanismen och miljön.
Den syntetiska miljön är i det här fallet en simulation av ett hjärta i ett laboratorium där man i tre dimensioner, istället för de vanliga tvådimensionella simulationerna, återskapar de förhållanden hjärtvävnaden lever i. Hjärtvävnaden fästs på ett gummiband (som gör en pumpande rörelse) som i sin tur fästs på en gummiplatta inuti en vakuumförseglad hinna av kollagena fibrer. Förseglingen gör att man kan ställa den mekaniska belastningen, syresättningen och den kemiska miljön för att simulera förhållandena för ett hjärta i en frisk kropp och för förhållandena som råder under och efter en infarkt.
– Hittills har man främst jobbat med plastskålar med hårda ytor, vilket innebär två dimensioner, en statisk och inte en mekaniskt aktiv miljö och inte mycket till matris att studera. Den modell vi nu byggt har vi åstadkommit tillsammans med ett holländskt samarbete.
De regenerativa cellerna (CPC) man intresserar sig för finns i speciella mikromiljöer i hjärtvävnaden. Växelverkan mellan mikromiljön och stamcellerna är oklar – det är oklart hur de påverkar varandra. I och med att mikromiljön förändras vid infarkt är det viktigt att förstå hur den förändrade miljön kan fungera inhiberande på de regenerativa cellerna.
– Det vi kan göra är att antingen modifiera reparationssignalen eller ändra miljön och se om reparationssignalen går fram eller ändras av miljöbytet och sedan se hur det påverkar aktiveringen av CPC – allt det här är enormt komplext och det har ännu inte forskats i den komplexa karakteristiken kring CPC och mikromiljön där de är lagrade.
– Som alltid då det gäller forskning får man gå fram med väldigt små steg, men det kan vi nu i och med den tredimensionella mikromiljö vi skapat. Vi kan justera mängden syre, ”hjärtfrekvensen”, och samtidigt studera molekylära processer som kommunikationen mellan cellerna och hur denna kommunikation påverkar cellernas funktion.
– Det som vi vid det här laget vet är att reparationssignalen är väldigt känslig för variationer i den mekaniska miljön och graden av syresättning. Reparationscellerna påverkas också: i vilken grad de bildar blodkärl, i vilken grad det sker en differentiering till muskelceller, vilka vägar de tar, och hur hela profileringen av vävnaden ändras.
– Målet är alltså att hitta ett sätt att aktivera de regenerativa cellerna i hjärtvävnaden så att man får hjärtat att reparera sig självt efter en infarkt. För det krävs förutom kunskapen om hur de cellulära signalerna påverkar cellernas regenerativa förmåga även teknologi för att kunna styra dessa signaler.
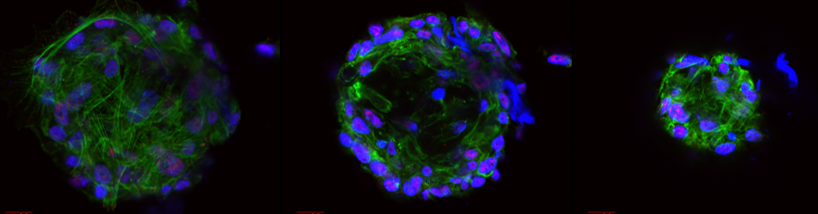
CPC – cardiac progenitor cells
Hjärtat verkar oförmöget att göra en större reparation av sig självt efter att det skadats till exempel i en infarkt. Studier har dock bekräftat förekomsten av ett hjärtvävnadsreparerande system av celler som kallas CPC (cardiac progenitor cells) som man vet väldigt lite om – dock vet man att de är aktiva hos foster och borde gå att aktivera hos vuxna personer.